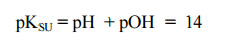pH Kavramı
Çözeltilerde hidrojen iyonu aktifliğinin eksi logaritmasına pH denir.
pH = – log [H + ]a eşitliği ile ifade edilir. Aktiflik de derişim (konsantrasyon) gibi litrede bulunan hidrojen iyonunun (H + )mol sayısıdır. Hidrojen iyonu aktifliğinin bulunması her zaman mümkün olmadığından günlük işlerde aktiflik yerine derişim alınır ve eşitlik,
pH = – log [H + ] şeklinde hidrojen iyonunun(H + ) molar derişimi cinsinden yazılır. Seyreltik çözeltilerde H + çok sayıda su molekülü ile çevrilmiştir. Ortamda H3O + (Hidronyum iyonları) mevcuttur. Bu çözeltilerde hidrojen iyonunun aktifliği ile derişimi arasındaki fark azalır. Çok seyreltik çözeltilerde aktiflik derişime eşit olur.
Hidroksil iyonu (OH¯) aktifliğinin eksi logaritmasına da pOH denir.
pOH = – log [OH¯]a Çok seyreltik çözeltilerde,Hidroksil iyonlarının (OH¯) aktifliği molar derişimine eşit olur.
pOH = – log [OH¯] pH genellikle 0-14 arasında değişir. Çok derişik ve çok seyreltik çözeltilerde bu sınırlar değişir. 0,10 N HCl’nin pH değeri 1 olarak hesaplanırken 0,10 N NaOH için pH değeri 13’tür. Çözeltilerde pH değerinin 1-6 aralığında olması ortamın asitli olduğunu, 7 ortamın nötr olduğunu, 8-14 ortamın bazik olduğunu belirtir. Hidronyum ve Hidroksil iyonları arasındaki denge saf suyun iyonlaşmasından yazılabilir.
Yukarıdaki eşitliğin eksi logaritması alınarak
-log’ lar “p” olarak ifade edildiğinden;
eşitliğinden pH ile pOH arasındaki bağıntı bulunur
Tekstil maddelerinin, doğal yapılarından kaynaklanan farklılıkların yanında ham maddeden ürün hâline gelinceye kadar uygulanan kimyasal işlemler sonucunda da pH değeri değişir. Tekstilin bir kolu olan giyim sektöründe, ürünün sahip olduğu pH değeri önemlidir. Özellikle, bebek giysilerinde ve doğrudan vücutla temas eden giysilerde pH değerinin ulusal ve uluslararası standartlarda olması ürünün kalitesini belirtir. Bu değerin doğru tespit edilmesi kimyasal analizin baştan sona kadar titizlikle yapılmasına bağlıdır.
pH Tayin Metotları
Tekstil ürünlerinin sulu çözeltilerinin pH değeri Kolorimetrik, Elektrometrik ve Spektrofotometrik olarak ölçülebilir. Bu modülde yaygın olarak kullanılan kolorimetrik ve elektrometrik yöntemlere yer verilmiştir.
Kolorimetrik Yöntemle pH Tayini
Numunenin derişimi bilinen bir sıra renkli çözeltiyle karşılaştırılıp tayin edilmesine kolorimetri, bu amaçla kullanılan alete de kolorimetre denir. Kolorimetreyle sadece renkli maddeler değil renklendirilebilen maddeler de tayin edilir. Kolorimetrik yöntemle pH tayini, pH indikatörleri ile yapılır. pH indikatörleri, ortamın H + derişimine göre renk değiştiren organik asit ve bazlardır. Kolorimetrik yöntemle pH tayininde, indikatörlerin (belirteç) renginin çözeltinin pH’ına bağlı olarak değişmesinden yararlanılır. Asidik indikatörler genellikle IndH, bazik indikatörler IndOH şeklinde gösterilirler. Buna göre indikatörler sulu ortamda,
Asit tipi indikatörlerde IndH ve Ind¯(asit ve konjuge baz hâli) farklı renklerdedir. Ortam rengini [IndH] / [Ind¯ ] oranı tayin eder. Baz tipi indikatörlerde de IndOH ve Ind+ (baz ve konjuge asit hâli) farklı renklerdedir. Bu nedenle ortam rengini [IndOH] / [Ind+ ] oranı tayin eder. İnsan gözü, renklerin her orandaki karışımını ayırt edemez. Gözün ayırt edebileceği renk karışımlarının oranı yaklaşık 1/10 veya 10’dur. Bundan dolayı bir indikatör
pH = pKi ± 1
aralığında kullanılabilir. Bu da bir pH indikatörünün ancak 2 pH aralığında kullanılabileceği anlamına gelir. İndikatörlerin pKi değerleri farklıdır. Bu nedenle renk değişimleri ve bu değişimlerin gözlendiği pH sınırları da farklıdır. Aşağıdaki çizelgede bazı indikatörler, renk değişimleri ve renk değişimlerinin gözlendiği pH sınırları verilmiştir.
İndikatörlerle çözeltilerin pH’ı tayin edilirken bu maddelerin çözeltileri kullanılabileceği gibi süzgeç kâğıdına emdirilerek kurutulmuş hâlleri de kullanılabilir. Genellikle indikatör çözeltisi emdirilmiş kâğıtlar, bu indikatörlerin renk değiştirdiği pH sınırları için pH kâğıtları olarak satılırlar. pH’ı ölçülecek çözeltiden bu kağıda bir damla damlatıldığında elde edilen renk, pH kâğıdı kutusu üzerindeki renklerle karşılaştırılır (Resim 1.2). Uygun renge karşılık gelen pH numunenin pH değeridir.
Elektrometrik (Potansiyometrik) Yöntemle pH Tayini
Elektrometrik (Potansiyometrik) yöntemle pH tayininde çözeltiye daldırılan iki elektrot yardımı ile oluşan galvanik pilin elektromotor kuvveti ölçülür. Potansiyometrik yöntemle pH ölçen aletlere pH metre denir. pH metreler hassasiyetlerine göre ibreli, elektronik göstergeli, kullanım amacına göre portatif ve masa tipi olmak üzere farklı büyüklükte tasarlanmışlardır. Deneyde kullanılan elektrotlardan biri indikatör diğeri referans görevini üstlenir.
İndikatör elektrot olarak kullanılan cam elektrot, kalın cidarlı cam veya plastik tüpün bir ucuna yerleştirilmiş ince pH duyarlı cam membrandan ibarettir. Bu tüpün içi gümüş klörür (AgCl) ile doymuş seyreltik hidroklorik asit (HCl) veya klorür iyonu (Cl¯ ) içeren bir tamponla doldurulmuştur. Gümüş tel, bir Gümüş / Gümüş Klorür (Ag / AgCl) referans elektrodu oluşturur ve potansiyel ölçme aletinin uçlarından birine bağlanır. pH tayininde metot, farklı hidrojen iyonu derişimlerine sahip iki çözeltiyi ayıran ince cam membranın iki yüzeyi arasında doğan potansiyelin ölçümüne dayanır. Elde edilen veriler doğrudan pH değerleridir.