Dispersiyon; Kelime anlamı dağılmadır. Birbiri içinde çözünmeyen en az iki maddenin bir yardımcı madde ile ya da yardımcı madde olmadan oluşturduğu homojen karışımlara dispersiyon denir. Dispersiyon oluşturmak için kullanılan yardımcı maddeye dispergatör ya da dispergir madde denir.
Örnek: Tebeşir tozu+su+dispergatör=dispersiyon Dispersiyonu oluşturan maddeler özelliklerini değiştirmez, kimyasal bir değişikliğe uğramaz.
Emülsiyon; Birbiri içinde çözünmeyen iki sıvının bir yardımcı madde ile ya da yardımcı madde olmadan oluşturduğu homojen karışımlara emülsiyon denir. Yani dispersiyonu oluşturan maddeler sıvı fazda ise bu dispersiyona emülsiyon denir.
Örnek: Yağ+su karışımı+emülgatör= emülsiyon
Süspansiyon; Birbiri içinde çözünmeyen bir sıvı ve bir katı maddenin yardımcı madde ile ya da yardımcı madde olmadan oluşturduğu homojen karışımlara süspansiyon denir. Yani dispersiyonu oluşturan maddelerden birisi sıvı diğeri katı ise bu dispersiyona süspansiyon denir.
Örnek: Tebeşir tozu+su+dispergatör= süspansiyon
Yüzey Gerilim; Bir gazla bir sıvının ya da birbiriyle karışmayan iki sıvının yüzeyleri gerilmiş esnek bir zara benzer. Bu gerilim sıvının serbest yüzeyine ait ise buna yüzey gerilim denir. İki sıvının yüzeyine ait ise ara yüzey (yüzeyler arası) gerilim denir.
Madde içindeki moleküller arasında kısa mesafede çekim kuvvetleri vardır. Bu kuvvetler nedeniyle moleküller sıvı hâldedir. Sıvının iç kısmında bulunan moleküller, ortalama tüm yönlerden eşit kuvvetlerle çekilmektedir. Dolayısıyla bunlara etki eden kuvvetlerin toplamı sıfırdır. Yüzeyde olanlar ise aşağıya doğru dengelenmemiş çekim kuvvetinin etkisi altındadır. Yüzeydeki molekülleri içeriye doğru çeken bu kuvvetler sınır yüzey gerilimini oluşturur. Sıvı-hava ara yüzeyinde de sınır yüzey gerilimi vardır.
Birçok molekül, sıvının iç kısmına doğru sıvının yüzeyini terk ettiği için yüzey kendiliğinden daralır. Bu nedenle sıvı damlaları ve gaz kabarcıkları küre şeklini almaya eğilimlidir.
Sıvılar arasındaki ara yüzeyde, çok büyük olmasa da dengelenmemiş kuvvetler vardır. Genellikle ara yüzey gerilimleri, iki sıvının yüzey gerilimleri arasında değer alır. Görünüşte durgun olan sıvı yüzeyinin, aslında sıvının hacmi ile yüzeyi ve yüzey ile buhar fazı arasındaki iki yönlü trafik sonucunda moleküller büyük bir kargaşa hâlinde bulunur. Sıvı yüzeyinde bir molekülün ortalama yaşam süresi 6-10 saniyedir.
Çoğu sıvı için yüzey gerilimi sıcaklık artışıyla doğrusal olarak azalır. Moleküller arası kohezyon kuvvetleri sıfıra yaklaştığında, kritik sıcaklık bölgesinde yüzey gerilim çok küçük olur.
Yüzey ve ara yüzey gerilimlerinin ölçülmesi:
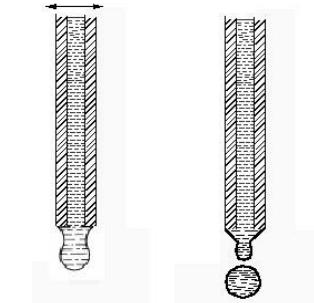
Yüzey ve ara yüzey gerilimlerinin ölçümü için kullanılabilen birçok yöntem vardır. En yaygın olarak kullanılan yöntem, damla hacmi ve damla ağırlığı metodudur.
Sıvı damlalarının, düşey olarak yükselen dar tüpün ucundan yavaşça kendi başlarına kopmaları beklenir. Damlalar ya tartılır ya sayılır ya da hacimleri ölçülür. Damla sayısı ya da damla hacmi az ise yüzey gerilim yüksek, çok ise yüzey gerilim düşüktür.
Yüzey gerilimi düşürmek için kullanılan maddelere yüzey aktif maddeler denir. Yüzey aktif maddeler bir sıvı içinde çözünebilen veya disperslenebilen, çözündükleri ya da disperslendikleri sıvının yüzey gerilimini düşüren maddeler olarak tanımlanabilir. Çok az miktardaki yüzey aktif madde ile çok büyük boyutlarda yüzey gerilim düşüşleri sağlanabilmektedir. Bu maddelerden tekstilde en çok kullanılanları ıslatıcı, sabun ve deterjan olarak adlandırılan maddelerdir.
Sulu tekstil işlemlerinde devamlılık çok önemli bir etkendir. Eğer tekstil işlemlerinde kullanılan su veya sulu çözelti yüzey aktif madde ihtiva ediyorsa bu su veya çözeltinin yüzey gerilimi düşer. Bu da tekstil mamulünün ıslanmasını ve böylece işlem görmesini kolaylaştırır.
Yüzey aktif maddeler ve benzerleri tarımdan torna sektörüne kadar her yerde kullanılır. Tarım ilaçlarında kullanıldığında ilacın böceklerin kabuk kısmında bulunan yağlı ve mumsu tabakadan geçmesini sağlar. Makine sanayinde torna işlemi sırasında metali ıslatarak onun soğumasını sağlar. Tekstilde ise kumaşın ıslanmasını ve kirin uzaklaşmasını sağlayan yardımcı kimyasal maddelerdir.
İyonlaşma; Bir molekülün anyon ve katyonlarına ayrılmasına iyonlaşma denir.
Diğer Kavramlar
Anyon: Eksi elektrik yükü taşıyan bir iyon ya da kök demektir. Örneğin, klor (Cl- ) eksi değerlikli bir anyondur.
Katyon: Artı elektrik yükü taşıyan bir iyon ya da kök demektir. Örneğin, sodyum (Na+) artı değerlikli bir katyondur.
Katalizör: Katıldıkları herhangi bir kimyasal reaksiyonun hızını artıran ama reaksiyonun sonunda herhangi bir değişikliğe uğramayan maddelerdir. Bazı katalizörler reaksiyonun bir basamağında tüketilirken diğer basamağında tekrar oluşur. Kimyasal bir madde olmamasına rağmen ışık bazı reaksiyonları hızlandırır. Bu nedenle ışık katalizör olarak nitelendirilir.
Stabilizör: Katıldıkları herhangi bir kimyasal reaksiyonun hızını yavaşlatan ama reaksiyonun sonunda herhangi bir değişikliğe uğramayan maddelerdir.
Süblimasyon: Erime noktası temperatürünün altında belirli derecede buhar basıncına sahip katı maddeler, ısıtıldıklarında sıvı hâli atlayarak doğrudan gaz hâline dönüşür. Katı hâldeki bazı maddelere enerji verildiğinde sıvı hâli atlayarak doğrudan gaz hâline dönüşmesine süblimasyon denir.
Örneğin, tuvaletlerde koku giderici olarak kullanılan “ernet” katı hâldedir. Bu madde hiç sıvı hâle geçmeden zamanla azalarak yok olur. Yünlü giysilerimizi güve zararlısında korumak için kullandığımız naftalin de zamanla iz bırakmadan yok olur. Bu maddeler katı hâlden gaz hâline geçerek süblimasyona uğrarlar.
Viskozite: Akışkanların (sıvı, gaz) akmaya karşı gösterdiği dirençtir. Başka bir deyişle akıcılık değeridir. Örneğin, balın viskozitesi suyun viskozitesinden çok yüksektir. Sıvıların viskoziteleri molekül yapıları ve moleküler arası etkileşimleriyle yakından ilgilidir. Bir sıvının viskozitesi iç sürtünme kuvvetinin akmaya karşı gösterdiği dirençtir. Viskozite ölçümlerinde sıcaklık önemli bir değişkendir. Bu nedenle tüm viskozite ölçümleri sabit sıcaklıkta (20± 0,1 °C) yapılır.
Boume (bome): °Be’ ile gösterilir. Yoğunluk, konsantrasyon değeridir. Bir maddenin yoğunluğu o maddenin birim hacminin gram olarak kütlesidir. Sıvıların yoğunluğu, genellikle belli hacimdeki sıvı tartılarak veya sıvının içine daldırılan bir cismin kaldırma kuvvetinden yararlanılarak tespit edilir. Ayrıca yoğunluk hidrometreler ile de ölçülebilir. Hidrometreler aşağıdan yukarıya doğru g/ml (yoğunluk) bome derecesi olarak işaretlenmiştir.
Agregasyon: Atom veya moleküllerin moleküller arası çekim ile (kohezyon) bir araya gelmesine agregasyon denir. Oluşan daha büyük moleküllere ise agregat adı verilir. Assosiatlar da özel agregatlardır.
Assosiat: Moleküllerin moleküller arası çekim kuvvetleri yardımıyla bir araya gelmeleri, molekül toplulukları oluşturmalarına assosiat denir.
İndikatör: Kelime anlamı belirteçtir. Asit ve baz tepkimelerinin yürüyüşünü izlemek için kullanılan bir çok madde vardır. Asidik ve bazik ortamda farklı renklerde olan zayıf organik asit ve baz yapısındaki bu maddelere indikatör denir. Önemli indikatörler metil oranj, metil kırmızısı, fenol ftalein ve turnusol kâğıdıdır.
Herhangi bir analiz işleminde sonucu görmek için kullanılır. Genellikle bitkisel maddelerden elde edilen ve ortamın asitliğine ya da alkaliliğine göre renk değiştiren maddelerdir. Analiz edilecek bir çözeltiye belirteç katıldığında, renkleri çözeltinin pH değerine göre değişen kompleks iyonlar oluşur. Turnusol kâğıtları ve standart belirteçler (örneğin pH kâğıtları) kimyasal analizler sırasında sıkça kullanılan belirteçlerdir.
Atom: Bir elementin bütün kimyasal özelliklerini taşıyan en küçük birimidir.
Bileşik: İki ya da daha fazla element içeren ve elementleri birbiriyle kimyasal olarak belirli oranlar hâlinde bağlanmış olan saf maddelerdir. Su (H2O) bileşiğinde hidrojen ve oksijen atomları birbirlerine 2:1 oranında bağlıdır.
Bileşiklerin özellikleri:
- Bileşikler kendilerini oluşturan elementlerin özelliğini göstermez.
- Saf maddelerdir. Belirli erime ve kaynama noktalarına sahiptir.
- Bileşiklerin özelliğini gösteren en küçük yapı taşına molekül denir.
- Bileşikler farklı cins atomlardan oluşur.
- Kendini oluşturan atomlara kimyasal yöntemlerle ayrıştırılabilir.
- Bileşiği oluşturan atomlar arasında sabit kütle oranları vardır.
- Bileşikler formüllerle gösterilir.
Derişim: Çözeltinin birim hacminde bulunan çözünmüş madde miktarıdır.
Higroskobik: Havadaki suyu çekme özelliğidir. Nem çekici maddeler higroskobik madde olarak bilinir.
Kolorit Nedir?
Koloit: Bir maddenin parçacıklarının başka bir madde içinde düzgünce dağılmış halde olduğu çözeltiye benzer bir karışım türüdür.
Karışım: İki ya da daha fazla saf maddenin (element ya da bileşik) kimyasal olarak birleştirilmeden yalnızca karıştırılarak bir araya getirilmesidir.
Karışımların özellikleri
- Karışımı oluşturan maddelerin kimyasal özelliklerinde değişiklik olmaz.
- Saf değildir.
- Fiziksel yollarla ayrıştırılır.
- Erime ve kaynama noktaları sabit değildir.
- Karışımların öz kütleleri sabit değildir. Karışımı oluşturan maddelerin miktarına bağlı olarak karışımın öz kütlesi değişir.
- Karışımın yapısında farklı cins atom veya molekül vardır.
- Karışımda bulunan maddelerin miktarı arasında belirli, sabit bir oran yoktur.
Bileşik ve karışım arasındaki farklar
- Bileşikler aynı cins moleküllerden, karışımlar farklı cins atom veya moleküllerden meydana gelir.
- Bileşikle kimyasal yollarla, karışımlar fiziksel yollarla birleştirilirayrıştırılır.
- Bileşikteki atomlar belirli kütle oranlarında birleşirlerken karışımlar için belirli bir oran yoktur.
- Bileşiklerin sabit bir öz kütleleri varken karışımların öz kütleleri karışımdaki maddelerin birleşme oranlarına bağlı olarak değişir.
Molekül: Bir bileşiğin tüm özelliklerini taşıyan ve bölünemeyen en küçük parçasıdır.
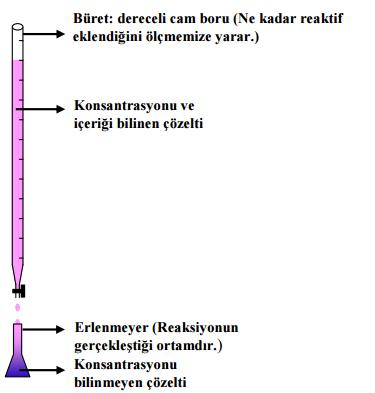
Titrasyon: Genellikle bir çözeltinin derişimini belirlemek için o çözeltiye derişimi bilinen başka bir çözeltiden belli bir miktarın eklenmesidir. Titrasyon asit-baz, kompleks oluşum, çökelme veya redoks reaksiyonlarında konsantrasyonu bilinen bir çözelti ile tepkimeye giren bilinmeyen bir çözeltinin konsantrasyonunu oluşan tepkimeden yola çıkılarak belirlenmesi tekniğidir. Bu işlem titrasyon düzeneğinde yapılır.